Tumormutationslast (TMB) und Immun-Checkpoint-Inhibition
Die Tumormutationslast (TMB) ist ein prädiktiver Biomarker, der das Ansprechen auf Immun-Checkpoint-Inhibitoren bei soliden Tumoren voraussagen kann. Eine hohe TMB korreliert mit einer erhöhten Anzahl von Neoantigenen und einer gesteigerten T-Zell-Aktivität, was die Wirksamkeit von Checkpoint-Inhibitoren verbessert. Allerdings ist die TMB nicht immer ein ausreichender Prädiktor. Fehler im Mismatch-Repair-System (MMR) und Mikrosatelliteninstabilität (MSI) können ebenfalls auf ein besseres Therapieansprechen hindeuten. Die Analyse der TMB wird bereits bei bestimmten Krebsarten wie nicht-kleinzelligem Lungenkarzinom (NSCLC) und Melanom in der klinischen Praxis eingesetzt.
Wissenschaftlicher Hintergrund
Die Bestimmung der Tumormutationslast (TMB) bei Patienten mit soliden Tumoren kann als prädiktiver Biomarker die Auswahl von Patienten unterstützen, die von einer Immun-Checkpoint-Inhibitor-Therapie profitieren können.
TMB wird als Anzahl somatischer kodierender, nicht-synonymer Varianten im Tumorgenom pro Megabase definiert und ist mit der Entstehung von Neoantigenen verbunden, die eine Antitumorimmunität auslösen. Dabei werden naive T-Zellen durch Antigen-präsentierende Zellen des Immunsystems aktiviert und führen zur Apoptose der Tumorzellen. Die Aggressivität zelltoxischer T-Zellen im Rahmen der Immunantwort ist jedoch reguliert. Bindet einer der Liganden PD-L1 oder PD-L2 an den PD-1-Rezeptor auf der aktivierten T-Zelle, wird deren zelltoxische Antwort unterdrückt. Um die Antitumorimmunität zu umgehen, nutzen die Tumorzellen diese Checkpoint-Regulation und erlangen eine Überexpression und somit Hochregulierung von Liganden inhibitorischer Rezeptoren, wie PD-L1, was zu einer starken Verminderung der Aktivität der zytotoxischen T-Zellen führt. Dieser Effekt kann in der klinischen Praxis mit therapeutischen Antikörpern gegen PD-1 oder PD-L1 allein (Checkpoint-Inhibitoren) oder in Kombination mit CTLA-4 (zytotoxischen T-Lymphozyten-assoziierten Protein 4)-Inhibitoren, mit Chemotherapie oder mit niedermolekularen Kinaseinhibitoren überwunden werden.
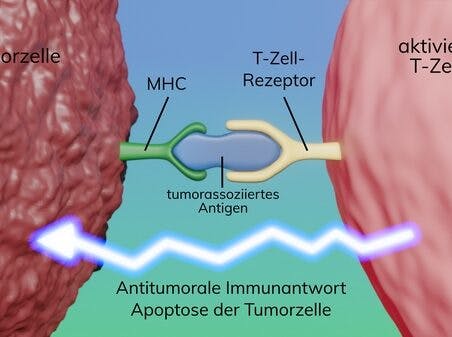
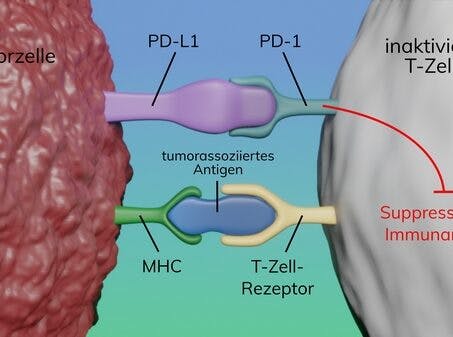
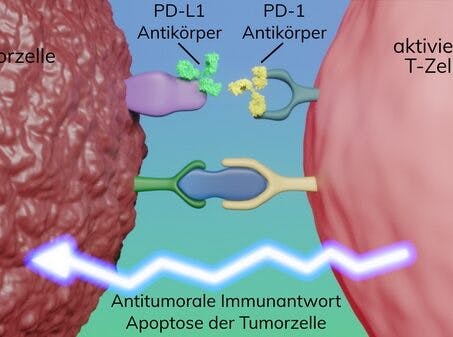
1. Durch das von der Tumorzelle präsentierte Antigen wird die T-Zelle aktiviert und eine antitumorale Immunantwort initiiert, die zur Apoptose der Tumorzelle führt. 2. Bindet einer der Liganden PD-L1 oder PD-L2 an den PD-1-Rezeptor auf der aktivierten T-Zelle, wird deren zelltoxische Antwort unterdrückt. 3. Mit therapeutischen Antikörpern gegen PD-1 oder PD-L1 kann die Unterdrückung der Immunantwort durch die Tumorzellen verhindert werden.
Tumoren mit einer hohen TMB exprimieren eine große Anzahl abnormaler Proteine, die vom Immunsystem als Neoantigene erkannt werden. Daher konnte auch gezeigt werden, dass Tumoren mit einer hohen TMB, unabhängig von einer durch Immunhistochemie nachgewiesenen PD-L1-Expression, und somit erhöhter T-Zell-Aktivität insbesondere von einer Immuntherapie mit Checkpoint-Inhibitoren profitieren. Allerdings ist die TMB allein nicht immer ausreichend, um ein Therapieansprechen vorauszusagen. Tumoren mit Fehlern im Mismatch-Repair-System (MMR) sind ebenfalls mit einer hohen TMB assoziiert. Das Vorhandensein einer sogenannten Mikrosatelliteninstabilität (MSI) aufgrund einer defekten DNA-Reparatur kann ebenfalls auf eine hohe TMB und besseres Ansprechen auf eine Immuntherapie mit Checkpoint-Inhibitoren hindeuten. So wurde Pembrolizumab von der FDA als erstes Medikament zur Behandlung von Tumoren mit MMR-Defekt unabhängig von Tumorart und –histologie zugelassen.
Aufgrund der oftmals limitierten Menge an FFPE-Tumorgewebe ist eine gleichzeitige Untersuchung von Therapie-relevanten Varianten, TMB und MSI in einem Ansatz möglich.
Anwendung findet die Bestimmung der TMB bereits beim nicht-kleinzelligen Lungenkarzinom (NSCLC). In den National Comprehensive Cancer Network (NCCN) Leitlinien wird eine Immuntherapie mit Checkpoint-Inhibitoren (Nivolumab mit oder ohne Ipilimumab) als Erstlinientherapie bei metastasierendem NSCLC mit hoher TMB empfohlen.
Das metastasierte bzw. nicht-reserzierbare Melanom war der erste maligne Tumor, der erfolgreich mit Checkpoint-Inhibitoren behandelt wurde. Dabei erwies sich die PD-L1-Expression nicht als zuverlässiger prädiktiver Marker, da auch PD-L1-negative Tumoren ansprachen und die PD-L1-Expression in etwa 50% der Fälle zwischen Primärtumor und Metastasen und zwischen Metastasen inkonsistent ist. Die TMB hingegen ist signifikant höher bei Personen mit gutem vs. schlechtem Ansprechen auf die Therapie.
Auch beim metastasierten Urothel (mUC) – und Nierenzellkarzinom (mRCC) sind von der FDA Checkpoint-Inhibitoren zugelassen. Daten aus klinischen Studien, die zur Zulassung von PD-1- und PD-L1-gerichteten Therapien bei mUC und mRCC führten, zeigen, dass die alleinige Verwendung der PD-L1-Expression unzureichend und ineffizient ist, um das Ansprechen der Behandlung vorherzusagen. Die Bestimmung der TMB kann hier unterstützen.
Zukünftig könnte bei Proben mit unzureichendem FFPE-Tumorgewebe die Analyse von zirkulierender Tumor-DNA (ctDNA) im Blut des Patienten Abhilfe schaffen, da präklinische Studien eine starke Korrelation zwischen der gewebe-basierten TMB und der ctDNA-basierten TMB zeigen.
Berland et al. 2019, J Thorac Dis, 11:S7 / Allgäuer et al. 2018, Transl Lung Cancer Res, 7:703 / Conway et al. 2018, Genome Medicine, 10:93 / Heeke, Hofmann 2018, Transl Lung Cancer Res, 7:631 / / NCCN Guidelines, NSCLC, Version 5.2019 / Zhu et al. 2018, J Immunother Cancer, 25:4 / Forschner et al. 2019, J Immunother Cancer, 12:180 / Laufer 2017, Immuntherapie gegen Krebs
letzte Aktualisierung: 4.11.2023