Schilddrüsenkarzinom
Schilddrüsenkarzinome sind die vorherrschenden endokrinen Tumoren mit unterschiedlichen epithelialen Ursprüngen und molekularen Veränderungen, die zu einer Aktivierung des MAPK-Signalwegs führen. Die meisten Fälle entstehen aus follikulären Zellen und werden als differenzierte Schilddrüsenkarzinome (DTC) klassifiziert, mit einer exzellenten Prognose bei Standardtherapie. Einige DTC zeigen aggressivere Verläufe, wobei molekulare Marker für eine präzisere präoperative Stratifizierung und Anpassung der Therapie genutzt werden können. Medulläre Schilddrüsenkarzinome (MTC) entstehen aus Calcitonin-produzierenden Zellen und können hereditär sein.
Wissenschaftlicher Hintergrund
Schilddrüsenkarzinome sind die häufigsten endokrinen Tumoren und verantwortlich für 1-5% der Tumoren bei Frauen und <2% bei Männern. Es handelt sich um eine heterogene Erkrankung, die aus zwei unterschiedlichen epithelialen Zelltypen hervorgeht. Die meisten Schilddrüsenkarzinome entstehen aus follikulären Zellen (follicular cell derived thyroid carcinoma). Dazu gehören papilläre (PTC;65-80%), follikuläre (FTC;10-30%), Hürthle-Zell- und schlecht differenzierte (OV-/PDTC; <2%) und anaplastische Schilddrüsenkarzinome (ATC; <2%). PTC und FTC werden zusammen als differenzierte Schilddrüsenkarzinome (DTC) bezeichnet und machen 90-95% aller Schilddrüsenkarzinome aus. Generell handelt es sich um langsam wachsende Tumoren mit exzellenter Prognose und 20-Jahres-Überlebensraten von >90% mit konventioneller Therapie, die aus einer Resektion mit oder ohne Schilddrüsenentfernung mit radioaktiver Jodtherapie und suppressiver Schilddrüsenhormontherapie besteht.
In der Mehrzahl der Fälle entstehen DTC durch molekulare Veränderungen in sogenannten Treibergenen wie BRAF, RAS oder durch die Entstehung von Fusionsgenen. Diese Veränderungen führen zur pathologischen Aktivierung des MAPK-Signalwegs, der eine Schlüsselposition in der Regulation vieler zellulärer Prozesse wie Proliferation, Differenzierung, Adhäsion, Migration und Apoptose innehat. Durch die Akkumulation weiterer molekulargenetischer Veränderungen z.B. in TERT, Tumorsuppressorgenen oder des Phosphoinositide-3-kinase (PI3K)-Signalwegs können DTC in dedifferenzierte PDTC oder ATC übergehen.
Ein Teil der Patienten mit DTC zeigt jedoch aggressivere Krankheitsverläufe mit rezidivierendem oder metastasierendem Verlauf und einer Unempfänglichkeit gegenüber einer Radiojodtherapie. Hier können molekulare Marker ggf. helfen, eine präzisere präoperative Stratifizierung vorzunehmen und das therapeutische Procedere auf den zu erwartenden klinischen Verlauf abzustimmen und somit die Prognose dieser Patienten zu verbessern.
Medulläre Schilddrüsenkarzinome (MTC) hingegen entstehen aus parafollikulären Calcitonin-produzierenden Zellen und können Teil der multiplen endokrinen Neoplasie Typ2 (MEN2) sein, einer erblich bedingten Disposition für die Entstehung medullärer Schilddrüsenkarzinome.
Diagnostik
Das papilläre Schilddrüsenkarzinom(PTC) stellt mit ca. 65-80% die mit Abstand häufigste Entität innerhalb der epithelialen Schilddrüsenkarzinome dar. Es ist molekulargenetisch charakterisiert durch chromosomale Rearrangements unter Einbezug des RET-Gens (RET/PTC-Rearrangements oder RET-Fusionsgene) sowie pathogene Varianten innerhalb der RAS– oder BRAF–Protoonkogene, die letztlich alle zu einer pathologischen Aktivierung des MAPK-Signalwegs (Abb.) führen. Varianten im BRAF– (Val600Glu, Lys601Glu), NRAS– (Codon 12, 13 und 61), HRAS– oder RET-Gen finden sich in nahezu 70% aller Fälle von PTC. Tumoren mit Varianten in BRAF sind häufiger undifferenziert und mit aggressiveren Tumoreigenschaften wie z.B. schlechterem Ansprechen auf eine radioaktive Jodtherapie assoziiert. BRAF Val600Glu findet sich in 45-59% der PTC, vorrangig in der klassisch papillären und großzelligen Variante und in bis zu 80% der Patienten mit rezidivierendem oder metastasierendem PTC. PTC mit Varianten in NRAS, HRAS und KRAS sind häufiger differenziert und finden sich in 10-20% der follikulären Variante des PTC. Dabei finden sich pathogene Varianten in BRAF und RAS nahezu nie gemeinsam in PTC-Tumoren. In bis zu 10% aller PTC werden zudem pathogene Varianten im TERT-Promotor (Cys288Thr; Cys250Thr) gefunden. Sie sind mit einem schlechteren klinischen Outcome assoziiert, insbesondere in Kombination mit BRAF-Varianten.
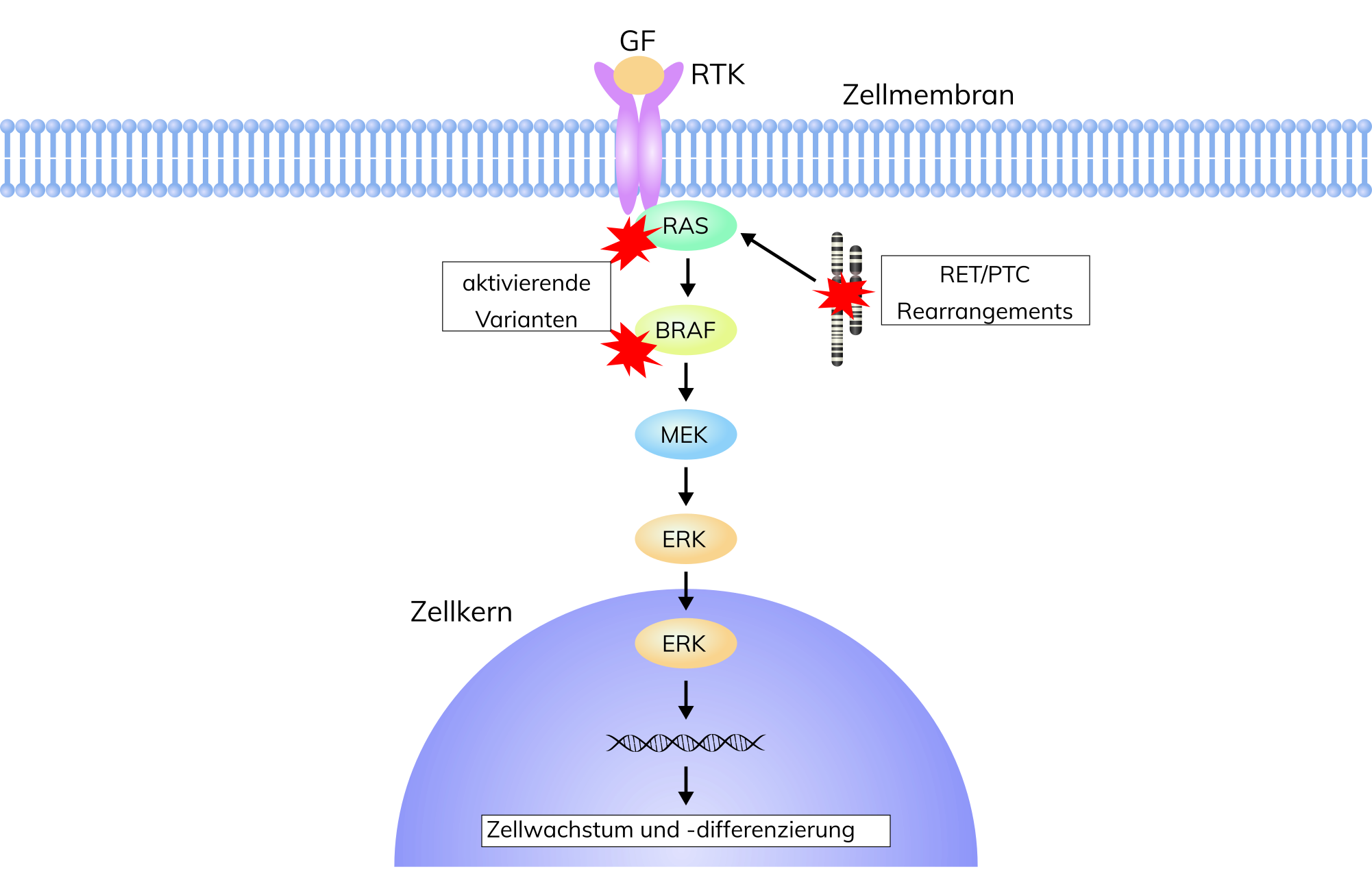
Das follikuläre Schilddrüsenkarzinom (FTC) ist mit einem Anteil von 10-30% die zweithäufigste Entität. Molekulargenetisch ergibt sich für das FTC ein anderes Variantenprofil mit einem relativ höheren Anteil von pathogenen RAS-Varianten (ca. 30-40% aller FTC) wohingegen BRAF Val600Glu und andere BRAF-Varianten nur selten gefunden werden (0-4%). Interessanterweise zeigen sich relativ häufig Veränderungen in einem weiteren Kandidaten-Treibergen, EIF1AX (5-7%). Die prognostische Wertigkeit dieser molekulargenetischen Befunde ist nicht abschließend geklärt, es ist aber möglich, dass sich die genetischen Variantenprofile als Basis für eine molekularpathologische Reklassifizierung der DTC eignen. Darüber hinaus werden TERT-Varianten auch bei einem Teil der FTC gefunden und scheinen auch hier mit einer deutlich schlechteren Prognose assoziiert zu sein.
Medulläre Schilddrüsenkarzinome (MTC) machen etwa 3-5% der Schilddrüsenkarzinome aus. Etwa 25% der MTC sind hereditärer Natur und zeigen Keimbahnvarianten im RET-Gen.Zusätzlich können in bis zu 66% der sporadischen MTC aber auch somatische Varianten in RET detektiert werden. Dabei zeigt sich in 75-95% eine RET Met918Thr-Variante, welche mit einem aggressiveren Verlauf assoziiert ist, ebenso wie die seltenere Ala883Phe-Variante (high risk Varianten). Auch das gleichzeitige Vorkommen mehrerer somatischer Varianten im RET-Gen ist mit einer schlechteren Prognose assoziiert. In bis zu 81% der sporadischen, RET-Wildtyp MTC finden sich Varianten in HRAS, vor allem die Variante Gln61Arg, seltener in KRAS. Die Rolle der Ras-Varianten ist weniger gut charakterisiert, es gibt jedoch Daten, dass Tumoren mit somatischen RAS-Varianten einen weniger aggressiven Verlauf nehmen als solche mit high-risk RET-Varianten, hingegen aggressiver als solche mit non-high risk-RET-Varianten. Auch der mTOR Signalweg ist aktiviert, sowohl im hereditären als auch im sporadischen MTC. Es gibt Hinweise, dass eine hohe mTOR-Aktiviät mit invasiveren sMTC und einer höheren Rate an Lymphknotenmetastasierung einhergeht. Die genaue Rolle von zielgerichteten Therapien mit Tyrosinkinaseinhibitoren und mTOR-Inhibitoren ist in Studien zu klären. Die Rolle epigenetischer Veränderungen (TERT-Hypermethylierung) und der Einfluss der microRNA-Expression (miR-183, 200, 21, 375, 224) ist Gegenstand aktueller Forschung, hat aber noch keinen Eingang in die medizinische Regelversorgung gefunden.
Song et Park 2019, Endocrinol Metab 34:1/ Abdullah et al. 2019, Int J Med Sci 16 / Fussey et al. 2019, Clin Endocrin 00:1 / Vuong et al. 2017, Clinical Endocrinology 87:411 / Moura et al. 2015, 22:5, R235 / Xing et al. 2014, J Clin Oncol 32:2718 / Carneiro et al. 2015, Cancer Treat Rev S0305-7372(15)00124-3 / Fallahi et al. 2015, Int J Mol Sci 16:6153 / Omur et al. 2014, Crit Rev Oncol Hematol 90:233 / Chernock et al. 2015, Am J Clin Pathol 143:768 / Li et al. 2012, Int J Clin Exp Med 5:310
letzte Aktualisierung: 4.11.2023