Diffus großzelliges B-Zell Lymphom, NOS (DLBCL)
Das diffus großzellige B-Zell-Lymphom (DLBCL), NOS ist die häufigste Form des Non-Hodgkin-Lymphoms bei Erwachsenen und zeichnet sich durch seine Aggressivität aus. Es entsteht aus reifen B-Zellen und kann in zwei molekulare Subtypen unterteilt werden: Keimzentrums-B-Zell-ähnliche (GCB) und aktivierten-B-Zell-ähnliche (ABC) DLBCL, die sich in ihrer Biologie und Prognose unterscheiden. Die Diagnose stützt sich auf histopathologische Untersuchungen und Immunphänotypisierung, wobei der Goldstandard eine Genexpressionsanalyse ist. Die Therapie erfolgt überwiegend mittels Immunchemotherapie mit dem Rituximab/CHOP-Schema, während in rezidivierten oder refraktären Fällen CAR-T-Zell-Therapien zugelassen sind.
Wissenschaftlicher Hintergrund
Das diffus großzellige B-Zell Lymphom, NOS stellt ca. 25-35% aller Non-Hodgkin-Lymphome des Erwachsenen und ist somit die häufigste Neoplasie des lymphatischen Systems. Es geht von reifen B-Zellen aus und zählt zu den aggressiven/blastischen B-Zell-Lymphomen. Üblicherweise entsteht das DLBCL, NOS de novo, es kann aber auch das Ergebnis einer malignen Transformation eines niedrig-malignen Lymphoms, v.a. des Follikulären Lymphoms oder der CLL sein. Unbehandelt führt es rasch zum Tode, der Therapieanspruch ist jedoch kurativ und mit modernen Kombinationstherapien werden Heilungsraten von bis zu 70% erreicht. Andere aggressive/blastische B-Zell-Lymphome werden nach der aktuellen WHO-Einteilung aufgrund ihrer besonderen klinischen Präsentation, Histologie, Immunphänotyp, genetischem Profil oder Assoziation zu infektiösen Agenzien vom DLBCL, NOS abgegrenzt, so auch das diffus großzellige B-Zell-Lymphom des zentralen Nervensystems. Auch von Lymphomen, die sich klinisch ähnlich manifestieren, müssen die DLBCL, NOS sicher abgegrenzt werden, so z.B. vom Hodgkin-, Burkitt- und Mantelzell-Lymphom sowie den peripheren T-Zell-Lymphomen.
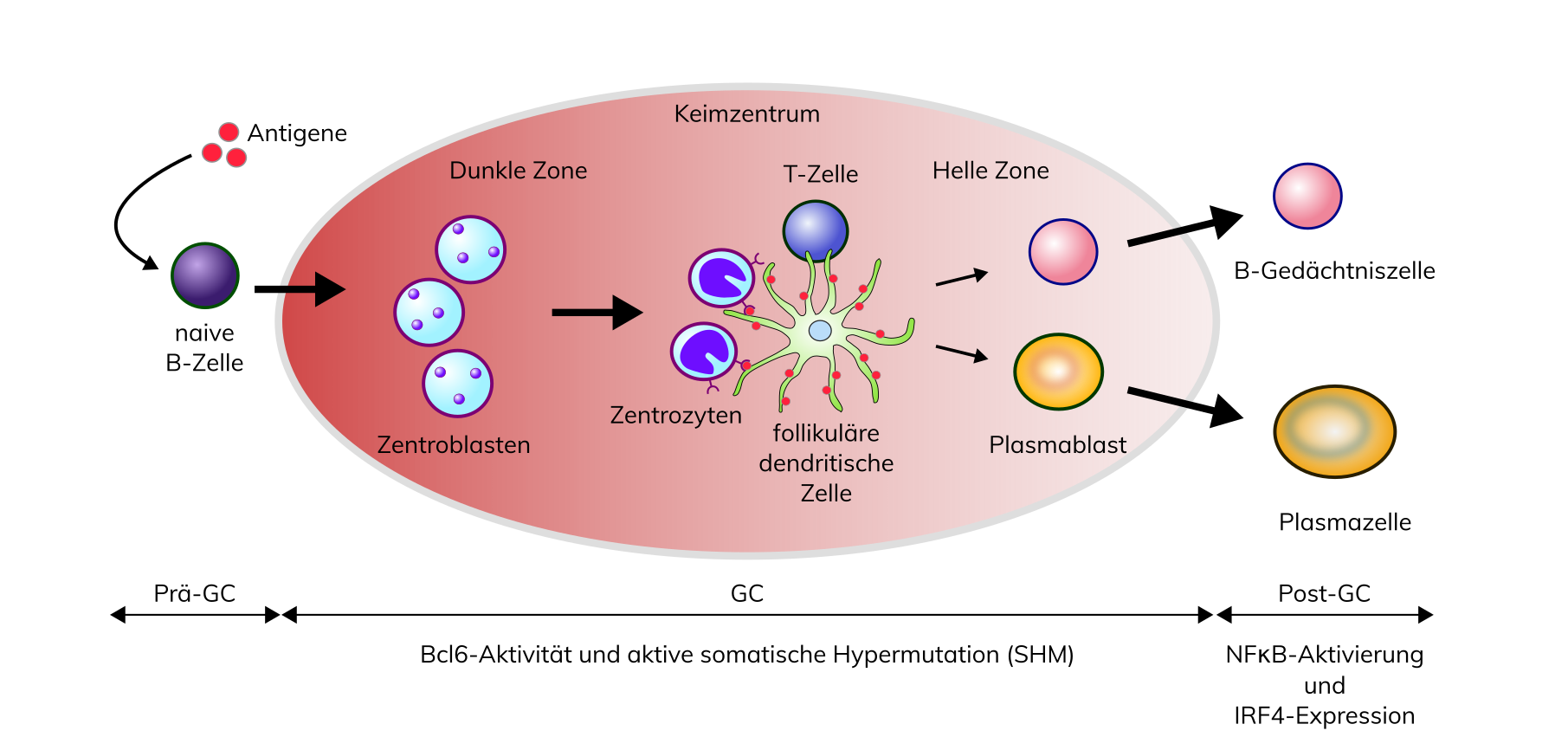
DLBCL stellen eine heterogene Gruppe von Erkrankungen dar. Anhand der Zytomorphologie werden DLBCL traditionell in zentroblastische, immunoblastische, anaplastische und seltene Varianten unterteilt. Mit Hilfe moderner Genexpressionsanalysen können nun, basierend auf Ähnlichkeiten mit der mutmaßlichen Ursprungszelle (Cell Of Origin, COO), molekulare Subtypen voneinander unterschieden werden: die Keimzentrums-B-Zell-ähnlichen (‚germinal center B-cell-like‘, GCB) von den aktivierten-B-Zell-ähnlichen (‚activated B-cell-like‘, ABC) DLBCL. Insgesamt weisen GCB- und ABC-DLBCL eine distinkte, Subtypus-spezifische Biologie auf, deren Einfluss auf Prognose und Therapie aber noch Gegenstand aktueller Forschung ist. Derzeit wird laut WHO für den ABC-Subtyp ein 5-Jahres-progressionsfreies Überleben von 40-50% und für den GCB-Subtyp von 70-80% angegeben. 10-15% der DLBCL, NOS können derzeit keinem der beiden Subtypen zugeordnet werden.
Hauptmanifestationsort sind die Lymphknoten, häufig auch die Milz und das Knochenmark. Auch extranodale Manifestationen sind nicht selten, zusätzlich können B-Symptome vorliegen. Die Knochenmarkinfiltration kann diskordant zum Lymphom, also kleinzellig imponieren. Da die Ausbreitungsdiagnostik essentiell in der Behandlung des DLBCL ist, gehört eine Knochenmarkhistologie und -zytologie zum diagnostischen Workup.
Als klinische Risikostratifizierung bzw. Prognosescore hat sich der sogenannte International Prognostic Index, kurz IPI, durchgesetzt. Dieser Score berücksichtigt klinisch messbare Parameter (Alter, Allgemeinzustand, Anzahl der befallenen Lymphknotenregionen, Befall extranodaler Organe, LDH-Erhöhung). Die sich hieraus ergebenden vier Risikogruppen (niedrig/niedrig-intermediär/hoch-intermediär/hoch) geben die statistische 3-Jahres-Überlebensrate an. Der aaIPI (age-adjusted) erlaubt eine Überlebensprognose unabhängig vom Alter und der NCCN-IPI trennt die Überlebenskurven der Risikogruppen noch sauberer, ist jedoch komplexer in der Handhabung. Zusätzliche vom IPI unabhängige klinische Risikofaktoren stellen u.a. eine sehr große Lymphommanifestation (sog. Bulk, >7,5cm), die großzellige (konkordante) Knochenmarkinfiltration sowie das Vorliegen der immunoblastischen Variante dar. Auch männliches Geschlecht und ein ausgeprägter Vitamin-D-Mangel sind prognostisch ungünstige Faktoren.
| International Prognostic Index (IPI) (1 Punkt pro Kriterium) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Alter > 60 Jahre | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| erhöhte LDH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
weitere Inhalte anzeigen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Diagnostik
Innerhalb der reifen B-Zell-Neoplasien gehören die DLBCL zu den genetisch komplexesten Lymphomen, mit einer Vielzahl von Veränderungen sowohl auf chromosomaler bzw. zytogenetischer (CNV, Translokationen) als auch molekulargenetischer Ebene (Genamplifikationen, Punktmutationen). Die initiale Diagnostik beruht auf der histopathologischen Untersuchung eines möglichst großen Gewebebiopsats oder eines befallenen Lymphknotens. Um die Einteilung gemäß der aktuellen WHO-Klassifikation vornehmen zu können, muss eine Testung auf CD20-Expression (falls CD20 negativ ist, weiterer B-Zell-Marker), eine Testung auf MYC-Translokationen und die Bestimmung des COO-Subtyps erfolgen. Der diagnostische Goldstandard zur Bestimmung des COO-Subtyps ist eine Genexpressionsanalyse, die derzeit jedoch keine Regelleistung der gesetzlichen Krankenkassen ist. Die Ermittlung der Proliferationsaktivität der Tumorzellen (Ki67-Index) ist ebenfalls von großer prognostischer Bedeutung. Da die differentialdiagnostische Abgrenzung anspruchsvoll sein kann, sollte eine Beurteilung durch einen erfahrenen Hämatopathologen, idealerweise zusätzlich referenzpathologisch, angestrebt werden.
Die Immunphänotypisierung erfolgt zumeist am Biopsat als Immunhistochemie, da es beim DLBCL, NOS selten zur Ausschwemmung von Lymphomzellen in das periphere Blut kommt. Dabei exprimieren die neoplastischen Zellen typischerweise Pan-B-Zell-Marker wie CD19, CD20, CD22, CD79a und PAX5, die jedoch nicht alle positiv sein müssen. 50-75% exprimieren membranständiges (sIg) und zytosolisches, (cIg) Immunglobulin (IgM>IgG>IgA). CD10 wird in 30-50% der Fälle exprimiert und CD30 in 10-20%. CD5 ist zumeist negativ, in 5-10% und vor allem bei de novo-Fällen aber positiv, was dann eine saubere Abgrenzung vom Mantelzelllymphom erfordert. Die gleichzeitige Expression von MYC und BCL2 ohne zugrundeliegende chromosomale Aberration (sog. double-expresser–Phänotyp) ist prognostisch ungünstig.
Zytogenetisch weisen diffus großzellige B-Zell-Lymphome in mehr als 30% der Fälle Translokationen mit der Region 3q27 unter Einbezug von BCL6 (häufiger beim ABC-Subtyp) und in 20-30% der Fälle mit der Region 18q21unter Beteiligung desBCL2-Gens (häufiger beim GCB-Subtyp) auf. MYC-Rearrangements (8q24) finden sich in bis zu 14% der DLBCL, NOS und zwar gleichmäßig verteilt auf beide COO-Subtypen. Sie sind häufig mit komplexen Karyotypen assoziiert. Etwa die Hälfte der DLBCL mit MYC-Rearrangements weist zusätzlich BCL2- und BCL6-Translokationen auf. Die gleichzeitige Translokation des MYC– und BCL2– und/oder BCL6-Onkogens im Kontext eines diffus großzelligen B-Zell-Lymphoms stellt einen ungünstigen Prognosefaktor dar (sog. Double-Hit-Lymphome). Sie werden nach der aktuellen WHO-Klassifikation in die neue Gruppe der High-Grade B-Zell Lymphome mit MYC und BCL2 und/oder BCL6-Rearrangement klassifiziert. Zudem werden Zugewinne in 2p16 (REL) in bis zu 30% der GCB-DLBCL, 3q27 (BCL6) in bis zu 45% und 18q21.3 (BCL2) in 55% der ABC-DLBCL gefunden. Deletionen der Regionen 1p36.32 (TNFRSF14), 6q21 (PRDM1) und 9p21 (CDKN2A) weisen ebenfalls ein charakteristisches Verteilungsmuster auf.
Molekulargenetisch finden sich rekurrente Varianten in epigenetischen Regulatorgenen, Transkriptionsfaktoren, Zellzyklusgenen und Signaltransduktionskaskaden. Auch hier zeigt sich ein charakteristisches Verteilungsmuster bezogen auf den COO-Subtyp. Während Varianten in EZH2, GNA13 fast ausschließlich im GCB-Subtyp vorkommen, finden sich Varianten in Komponenten des NF-kB-Signalwegs wie CARD11, MYD88 und CD79a/b charakteristischerweise beim ABC-Subtyp. Varianten in TP53, FOXO1 und CREBBP finden sich ubiquitär. Passend zum COO-Subtyp kann beim GCB-DLBCL eine anhaltende somatische Hypermutation nachgewiesen werden, während diese bei dem ABC-DLBCL bereits abgeschlossen ist.
Auch das den Tumor umgebende Zellmilieu, das sogenannte Microenvironment, scheint eine wichtige Rolle für die Kontrolle bzw. Progression der Lymphome zu spielen und ist Gegenstand aktueller Forschung.
Die kombinierte Immunchemotherapie mit dem Rituximab/CHOP-Schema stellt nach wie vor den Goldstandard dar. Außerhalb von Studien erfolgt derzeit keine Stratifizierung nach dem COO-Subtyp oder weiteren molekularen Risikofaktoren. Im Rezidiv oder bei therapierefraktärer Erkrankung ist bei erwachsenen Patienten die Therapie mit CAR-T-Zellen zugelassen.
Herman 2018, Blood 131:2278 / Chapuy et al. 2018, Nat Med 24:679 / Dührsen et al. 2018, Onkopedia Leitlinien der DGHO, OeGHO, SSMO und SGHSSH / Swerdlow, Campo, Harris, Jaffe, Pileri, Stein, Thiele (Eds), 2017, WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues (Revised 4th edition), Chapter 13:291 / Quintanilla-Martinez 2015, Hematol Oncology 33:50 / Read et al. 2014, Clin Lymph Myeloma Leuk 14:460 / Alizadeh et al. 2000, Nature 403:503
letzte Aktualisierung: 2.11.2023